Bicarbonate de soude et vinaigre
Réactions et démonstrations
"Le bicarbonate de soude et le vinaigre
peuvent donner lieu à des réactions drôles
et même spectaculaires"
Bicarbonate de soude et vinaigre, qui n'a pas ces produits chez soi ? On trouve ces produits partout. De plus, ces matériaux sont sécuritaires au point de départ et ils le sont toujours à la fin de la réaction. Cela explique sans doute pourquoi cette réaction est populaire et l'une des premières à laquelle les gens sont exposés.
En fait, la réaction chimique bicarbonate de soude et vinaigre est utilisée fréquemment pendant les cours de science, dans les écoles publiques jusqu'aux universités pour démontrer et analyser les réactions chimiques.
Cette réaction aux utilisations variées est utilisée de plusieurs façons à la maison ou à l'école. Nous traiterons ici de :
- Description d'une réaction chimique
- Lancement d'une fusée
- Fabrication d'une bombe «bulle»
- Éruption d'un volcan
- Démonstration de la stoechiométrie d'une réaction chimique
- Analyse de la réaction quant aux changements de température, du pH et de la masse
Description de la réaction chimique bicarbonate de soude et vinaigre
Le bicarbonate de soude, un produit chimique pur nommé sodium de bicarbonate a la formule suivante :
NaHCO3
Lorsque dissout dans l'eau, le bicarbonate de soude se sépare en sodium (Na+) et en ions de bicarbonate (HCO3-) :
NaHCO3 ---> Na+ (aq) + HCO3- (aq)
Dans l'eau, le vinaigre, une solution faible en acide acétique (5%), se dissout partiellement en hydrogène (H+) et en ions d'acétate (CH3COO-) :
CH3COOH <--> H+ (aq) + CH3COO-(aq)
La réaction bicarbonate de soude et vinaigre est en fait le résultat de DEUX réactions : une réaction acide de base suivie d'une réaction de décomposition.
Quand les deux ingrédients sont mélangés, les ions d'hydrogène (H+) du vinaigre réagissent avec les ions de bicarbonate du bicarbonate de soude pour former un nouveau produit chimique appelé l'acide carbonique (H2CO3).
H+ + HCO3- ---> H2CO3
L'acide carbonique ainsi formé se décompose immédiatement en un gaz, le dioxyde de carbone (CO2), et en eau (H2O).
H2CO3 ---> H2O + CO2
C'est le dioxyde de carbone qui est responsable de la formation de bulles et de mousse dès qu'on mélange du bicarbonate de soude et du vinaigre.
En utilisant les structures moléculaires des ingrédients impliqués, la réaction chimique peut être écrite comme suit :

ions de bicarbonate + ions d'hydrogène ---> eau + dioxyde de carbone
Cependant, l'ensemble de la réaction est fréquemment écrite comme suit:
NaHCO3 (aq) + CH3COOH (aq) ---> CO2 (g) + H2O (l) + CH3COONa (aq)
Retournez en haut.
Vous pouvez soit fabriquer votre propre fusée - alimentée de bicarbonate de soude et vinaigre - à partir d'articles provenant de la maison, soit vous procurer un ensemble de science qui permet de lancer une petite fusée en plastique à environ 33 mètres (100 pieds) dans les airs.
La méthode de fabrication maison requiert un petit contenant pour  pellicule vide (celui de Fuji film fonctionne bien), du vinaigre et du bicarbonate de soude.
pellicule vide (celui de Fuji film fonctionne bien), du vinaigre et du bicarbonate de soude.
Attention : faites cette expérience à l'extérieur
et portez des lunettes protectrices.
- Enlevez le couvercle du contenant pour pellicule et remplissez-le àingrédients dans contenant fond de bicarbonate de soude.

- Ajoutez deux cuillères à thé de vinaigre dans le contenant.
- Placez soigneusement le couvercle sur le contenant et poussez fermement pour assurer une bonne étanchéité.s.
- Renversez rapidement le contenant, la tête en bas. Placez-le sur une surface à niveau et reculez-vous..
Après quelques secondes, le contenant sera propulsé dans les airs. Cela est dû à l'accumulation de la pression causée par la formation du gaz, le dioxyde de carbone.
Si le contenant ne lève pas, changez de contenant. Essayez d'en trouver un avec un couvercle qui offre une meilleure adhérence.
Plutôt que de lancer un contenant pour pellicule, vous pouvez faire éclater un sac en plastique clair avec le gaz dioxyde de carbone provenant de la réaction bicarbonate de soude et vinaigre. Tout ce dont vous avez besoin est un sac à sandwich de type Ziplock et une serviette en papier.
Attention : faites cette expérience à l'extérieur et portez des lunettes protectrices.
- Placez une cuillère à table et demie de bicarbonate de soude au centre de la serviette en papier et pliez la serviette en un petit carré, de manière à garder la poudre à l'intérieur.
- Mettez une demi-tasse de vinaigre et un quart de tasse d'eau tiède dans le sac Ziplock.
- Insérez la serviette de papier dans l'ouverture du sac Ziplock mais EMPÊCHEZ-la de tomber dans la solution en pinçant le haut du sac
- Fermez le sac Ziplock au complet, puis laisse tomber la serviette de papier dans la solution de vinaigre et d'eau tiède.
Le sac se remplira de gaz dioxyde de carbone et éclatera en faisant un bang, alors, il est important d'être dehors ou de faire l'expérience dans un évier…
Retournez en haut.
La mousse et le pétillement produits par la réaction bicarbonate de soude et vinaigre peuvent être utilisés pour démontrer une éruption volcanique.
Vous aurez besoin d'un modèle de volcan fait de pâte à modeler ou de plâtre de Paris dans lequel il y aura un puits central capable de loger le contenant dans lequel les réactifs seront placés.
- Mettez deux cuillerées à table de bicarbonate de soude dans le contenant situé dans le puits du volcan.
- Afin de rendre la démonstration plus réaliste, ajoutez quelques gouttes de colorant alimentaire à un quart de tasse d'eau tiède et ajoutez le tout au bicarbonate de soude.
- Ajoutez une demi-tasse de vinaigre au mélange et observez l'éruption volcanique.
N.B. Vous aurez besoin de plusieurs serviettes de papier pour nettoyer les dégâts à la suite de cette démonstration.
Il est beaucoup plus facile de démarrer avec un trousse telle le «4M Volcano Making Kit![]() ». Elle contient les pièces d'un volcan qui s'assemblent facilement en se cliquant les unes dans les autres, de même que du plâtre et de la peinture à l'eau. Disponible sur Amazon.com, la trousse reçoit d'excellentes critiques des consommateurs.
». Elle contient les pièces d'un volcan qui s'assemblent facilement en se cliquant les unes dans les autres, de même que du plâtre et de la peinture à l'eau. Disponible sur Amazon.com, la trousse reçoit d'excellentes critiques des consommateurs.
Démonstration de la stœchiométrie d'une réaction chimique
bicarbonate de soude et vinaigre
Voici une façon fréquemment utilisée pour démontrer la stœchiométrie de la réaction chimique bicarbonate de soude et vinaigre. Placez l'ouverture d'un ballon gonflable contenant du bicarbonate de soude sur une bouteille d'eau en plastique propre dans laquelle on a versé du vinaigre. Le bicarbonate de soude contenu dans le ballon tombe dans la bouteille et se mélange au vinaigre. Les gaz émanant de la réaction qui s'en suit exercent une pression sur le ballon qui se gonfle.
Le ballon deviendra plus ou moins gros, selon la quantité de dioxyde de carbone produit, laquelle est proportionnelle à la quantité de bicarbonate de soude et de vinaigre utilisée.
- Mettez 1 cuillerée à thé de bicarbonate de soude (4gr de bicarbonate de sodium) dans le ballon gonflable.n.
- Versez 4 cuillerées à table de vinaigre (60 ml à 5% d'acide acétique) dans une bouteille d'eau vide de 1 litre.
- Étirez l'ouverture du ballon pour la fixer sur la bouteille, puis placer le ballon de façon à ce qu'il soit complètement vertical afin que tout le bicarbonate de soude tombe à l'intérieur, sur le vinaigre
Comparez la grosseur du ballon lorsque vous faites les modifications suivantes
- Essayez l'expérience en utilisant la MOITIÉ des quantités du bicarbonate de soude ET de vinaigre
----------------------
- Essayez maintenant en utilisant la MOITIÉ du bicarbonate de soude mais la MEME QUATITÉ de vinaigre.
La réaction bicarbonate de soude et vinaigre peut être observée en analysant les changements de température, du pH, de la masse et d'autres paramètres au cours du déroulement de la réaction, jusqu'à la fin.
Cependant, pour réussir cette analyse adéquatement, il faut un équipement de laboratoire passablement coûteux qui soit branché à un ordinateur dédié et doté de logiciels spécialisés. Ce n'est pas une expérience qui se fait normalement chez soi.
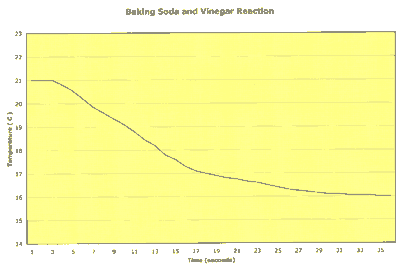
Voici un exemple de lecture des fluctuations de la température dans le temps durant une réaction :
Notez que la durée totale de la réaction est de moins d'une minute (environ 26 secondes) et que la température baisse de façon significative durant la réaction. Ceci est un exemple de réaction endothermique, c'est-à-dire une réaction qui nécessite de la chaleur pour se produire.
Retournez en haut.